研究内容の詳細
ヒト組織の成り立ちを理解し,育む技術を構築・利用する
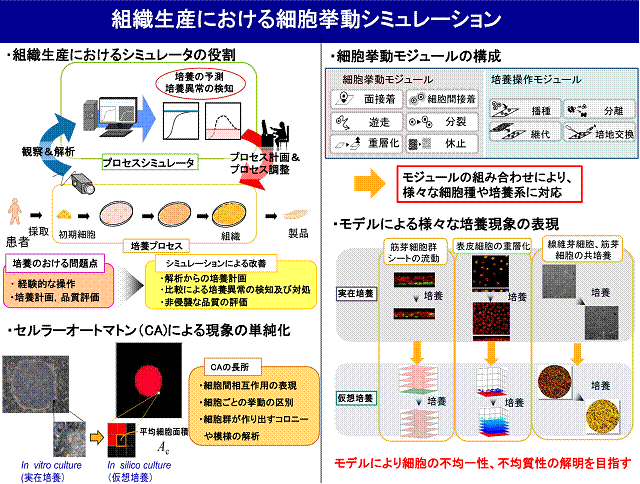
組織工学の技術を用いた再生医療における研究は,培養組織ごとに個々の研究者が医学,工学の両分野の境界領域にて行われてきた.特に,組織工学領域の発展は,種々の細胞群から組織への再構築を可能とし,培養組織を移植素材として利用することが可能となってきた.結果,再生医療分野における企業化へと導き,培養組織を生産するに至っている.しかし,組織工学製品を実際に生産する際には,組織を問わず共通する生産原理を導く必要がある.また,実生産における組織培養工程では,患者ごとに細胞特性が変化したり(原料の不均質性),患部の大きさが変わる(生産量と生産時間の変動),3次元スキャフォード内において位置的細胞的分布を持つ(不均一性),再現性の乏しいバッチプロセスと考えられ,細胞および組織特性の定量的評価が必要不可欠となる.よって,品質評価,規格化の観点からもin vitroでのヒト組織再構築過程における空間的不均一性,細胞的不均質性を考慮したシミュレータの開発ならびに培養操作の設計を試みが重要と考えられる.共通するモデル原理の理解は,培養工程の改善の是非について評価することができ,組織工学製品全般の品質に対する規格化の指針創出が実施可能であると思われる.
我々は,ヒト組織再構築中に生じる環境的ヘテロ集団(不均一性),細胞的へテロ集団(不均質性)に対する分業組織の解明を目指し,細胞レベル(微視的レベル,mmオーダー)での増殖・分化の現象を局所把握かつ1細胞ごとに生じるイベント(分裂・遊走・物質生成)を生物的パラメータにて整理する.さらに空間的・時間的積分することにより,細胞間のコミュニケーションを加味した組織レベル(巨視的レベル,mm,cmオーダー)で集塊増殖,分化,シグナリングに関する解析の方法論を構築する.また,将来手的に,実在培養(in vitro culture)のデータを基に,へテロを考慮し,かつ立体的・時系列的変化に対応したシミュレーションツールを構築し,仮想培養(in silico culture)を実施することで,「ヘテロな集団内での分業組織の解明」の一端を担う.特に,これまでのヒト培養細胞を用いた組織再構築のため培養方法の確立,および,生産プロセスにおける培養組織の質的評価を目指し,培養経過のシミュレータの開発および培養終了時の立体的組織評価手法の構築を目指している.
1. 多分化能を有するヒト幹細胞の分化制御を目指した培養面構築
2. 臨床応用を目指したヒト培養組織の生産プロセスに関する研究
1.多分化能を有するヒト幹細胞の分化制御を目指した培養面構築
再生医療は,ヒトの細胞(特に患者の細胞)の採取,体外での細胞増幅培養,組織化培養,疾患部への移植という一連の工程から成る.患者自身から得られた幹細胞に対し,体外での細胞増幅培養,組織化培養を施す際に,それぞれ,細胞の未分化性の維持や目的とする分化への制御することが不可欠となる.その際,細胞増幅培養および組織化培養において,細胞には付着する場(足場)が必要であり,これが,増殖能力,分化能力を左右する最も重要な環境因子の一つであることが知られている.多くは,液性因子の添加による分化制御を目指しているが,近年,培養面の役割についても注目されている.これまで,骨格部としてのデンドリマー構造,リガンド部としてのD-グルコース,種々の密度等の変数設計にて,トランスポータターゲットによる形態制御を試み,基盤技術として培養面の設計戦略を構築した.本手法は,骨格部,リガンド部を種々変化させることにより,培養面設計の展開が期待される.
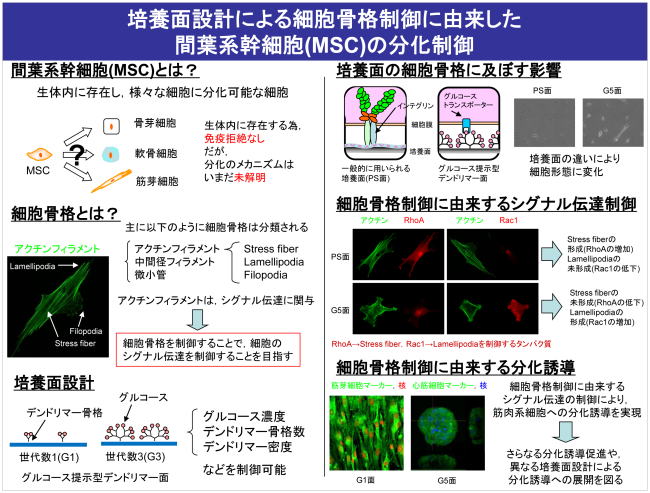
2.臨床応用を目指したヒト培養組織の生産プロセスに関する研究
再生医療に対する生物化学工学の貢献を目指し,研究に従事してきた.その中で,移植を前提とした培養細胞・組織の生産は,従来の医薬品製造プロセスとは異なり,患者自身の細胞が原料,移植細胞・組織が製品であるテーラメイドプロセスとなり,原料の不均質性,生産スケールの変動など固有の特徴を見出し,培養を中心とする工程管理および細胞・組織製品の品質管理の手法確立が不可欠であることを示してきた.
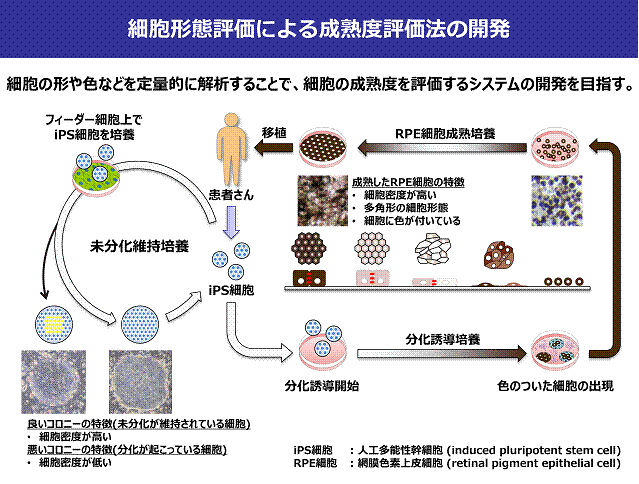
表皮培養システムの構築において,皮膚角化細胞を用いた2次元単層培養のための操作の自動化を試み,得られた細胞を患部に対し移植治療を実践してきた.さらに,角化細胞の平面(単層)培養時において,細胞個々の接着・分裂を表現した細胞配置型増殖モデルを構築した.本モデルを,培養スケジューリングへ適用し,培養装置との統合により,自動的な継代培養システムを構築した.
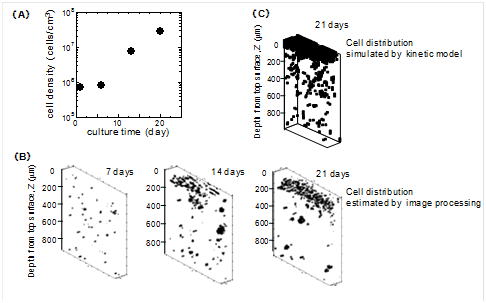
軟骨組織培養プロセスの構築では,コラーゲンゲルに包埋された軟骨細胞からなる軟骨培養組織に対する生産手法構築を行った.細胞生理学的な問題点(軟骨細胞では,2次元的な培養面での継代培養を重ねると脱分化が進行しその機能を消失する)を解決するため,軟骨細胞の脱分化を抑制しつつ細胞増幅が可能な高密度コラーゲン面を開発し,平面での細胞増幅後,ゲル包埋(3次元)培養にて組織形成する次世代生産プロセスを提案した.また,細胞群の不均質性ならびに空間的不均一性を考慮し,3次元の細胞増殖を予測できる細胞配置モデルの構築ならびにゲル内での細胞不均一分布評価法の構築等を行い,培養組織の生産工程管理および品質管理を実施する際の実践的ツール開発を行っている.本研究は,JSTの委託開発事業(2001−2007年)のもと共同研究(ジャパンティッシュエンジニリング,広島大学,大阪大学)で実施されたものであり,事業終了時においては,医療用途製品の生産プロセスの構築ならびに臨床試験終了に至り,実用的な成果に導いた.
|
コラーゲンゲル内の軟骨細胞の立体的増殖経過. |
ヒト筋芽細胞シートの生産プロセスの構築では,筋芽細胞からなる積層細胞シートを対象とした品質管理に関する解析技術の構築を行っている.本シート内において,分化に伴う細胞群の不均質性や住み分けによる空間的不均一性が生じる.これらの定量的解析の方法論構築と伴に,培養中に見られる種々の速度パラメータにて整理することで製品である培養組織の評価を行っている.特に,立体組織片観察ツールを構築し,細胞コミュニケーションをシート内血管形成時における増殖細胞の局所密度,その位置的分布,ネットワーク形成度などで定量解析している.さらに,シート内筋芽細胞流動,血管内皮細胞遊走・凝集を考慮した血管形成シミュレータを構築し,患者治療成績を予測できる“in silico プロダクション”を実現することを目指す.
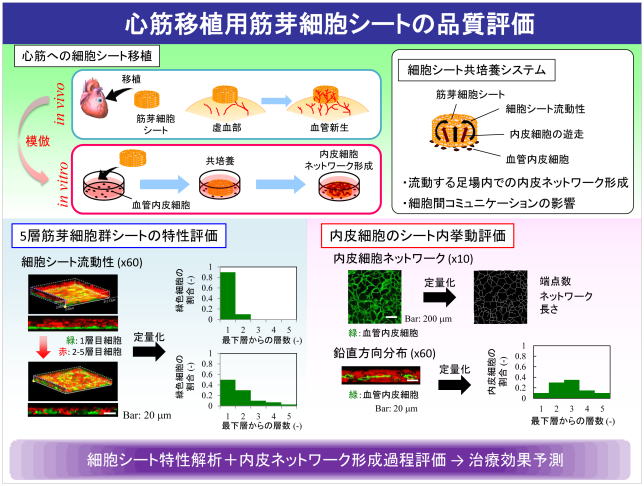
3. 培養組織生産プロセスの自動化
移植治療の分野において,近年,細胞をin vitroで培養し,その後,組織や臓器へと分化させ,最終的には患者へ移植・再構築させる治療法が研究されている.しかし,現在のところ,生化学,発生医学的な質的改善に対する研究は盛んであるものの,培養皮膚の生産方法などの培養工学的見地からの研究は少ない.本研究テーマでは,角化細胞の皮膚組織への3次元再構築を実現できる完全自動化培養リアクターの開発を最終目的として,まず基礎的な増殖速度および細胞内の物質移動の速度論的解析を行い,さらに小スケールにおいて,皮膚組織の3次元的に再構成させるためのリアクターの構築を目指している.
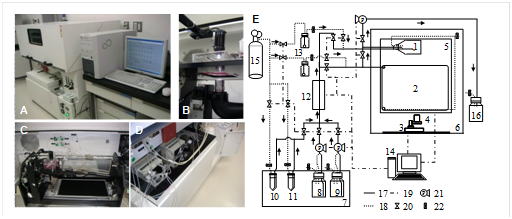
自動継代可能なインテリジェント培養システム 1;第1培養容器,2;第2培養容器,3;電動ステージ,4;デジタルカメラ,5;容器設置台, 6;インキュベータ,7;冷蔵庫, 8; 新鮮培地,9;緩衝液,10;細胞剥離液,11;剥離停止液,12;ヒータ,13;加湿器,14;コンピュータ,15; 供給ガスボンベ(5% CO2/air), 16; 使用済み培地,17; 液ライン,18;ガスライン,19;電気シグナルライン,20;電磁バルブ,21;チューブポンプ,22;無菌フィルター Tissue Eng., Vol.15 No.4, pp. 717-728 (2009) |
以上,“ものづくり”を礎としたアウトプット側からのアプローチを重視した研究を展開する.さらに,私は,汎用性の分析・解析装置を用いるだけの研究ではなく,ハードとソフト両面からの“役に立つ道具作り”から始め,その結果得られる新しい現象を解明ならびに定量的解析することで新しい領域の創成を目指していきたい.