![]()
ウイルスとはなにか。
 ウイルスは生命の特徴を利用して、これに感染し、自分を増やす非生命体である。ウイルスの仲間には、細胞性生物と同じようにDNAを遺伝子として用いているものだけではなく、RNAを遺伝子に用いているものも多い。RNAはDNAに比べて化学的に不安定であり、基本的に一本鎖で存在しているためその複製過程に校正プロセスが存在せず、突然変異率が高い遺伝子になってしまう。しかし一方、突然変異率が高いことが幸いして、急激な環境変化にすばやく適応できる可能性を有しているとも考えられる。そこで、RNAを遺伝子としているウイルスの中で、実験室で容易に培養できるため扱いやすく、多角的によく研究されている大腸菌を宿主とするバクテリオファージ(以後、ファージ)を用いて、人類にとって敵であり続けたウイルスとの新たな共存方法を見つけるべく、その本質的な生き残り戦略を解明するとともに、ウイルスを有効利用する新しい方法も探っていきたい。
ウイルスは生命の特徴を利用して、これに感染し、自分を増やす非生命体である。ウイルスの仲間には、細胞性生物と同じようにDNAを遺伝子として用いているものだけではなく、RNAを遺伝子に用いているものも多い。RNAはDNAに比べて化学的に不安定であり、基本的に一本鎖で存在しているためその複製過程に校正プロセスが存在せず、突然変異率が高い遺伝子になってしまう。しかし一方、突然変異率が高いことが幸いして、急激な環境変化にすばやく適応できる可能性を有しているとも考えられる。そこで、RNAを遺伝子としているウイルスの中で、実験室で容易に培養できるため扱いやすく、多角的によく研究されている大腸菌を宿主とするバクテリオファージ(以後、ファージ)を用いて、人類にとって敵であり続けたウイルスとの新たな共存方法を見つけるべく、その本質的な生き残り戦略を解明するとともに、ウイルスを有効利用する新しい方法も探っていきたい。
ファージ研究の背景
地球を代表する遺伝子資源であるファージのことをもっと詳しく知るためには、感染サイクルが定量的に理解されていない点が多く、調べなおす必要がある。
- ウイルスは生物ではないが、一連の物理的・化学的過程である「感染サイクル」を達成することで、存続している遺伝子である。
- バクテリオファージ(ファージ)とは生きたバクテリアを宿主とし、それに感染することで増殖するウイルスのことである。
- 地球上には非常に大量かつ多彩なバクテリアとバクテリオファージが存在していると試算されている(地球上はファージであふれている)。
- 遺伝子の生き残り戦略の中核ルールの理解のためにモデルとしてファージを用いるときや、工学・医学的なファージ利用法を考える場合、感染サイクルの各プロセスの定性的な理解だけでは不十分であり、速度論的・確率論的な理解がこれまで以上に求められる。
これらをふまえ、わたしたちは以下に示す3つのテーマを柱にして研究を進めている。
研究の3つの柱
1.バクテリオファージの感染サイクル/ Infection dynamics of bacteriophages
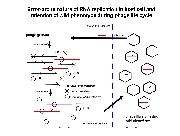
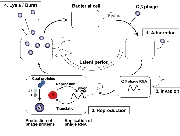
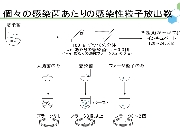
 大腸菌を「宿主」としたRNAウイルスであるQβファージは、セントラルドグマに含まれない反応である RNAの複製過程によってそのゲノムを増幅する。一般にRNA複製反応には校正機構が無く、高い変異導入率を有するため、ファージゲノムの複製段階では高いerror rateにより自身の増幅が邪魔される筈である。実際、Qβファージのゲノムは4200塩基ほどの一本鎖RNAだが、報告されている突然変異率は6.5(/genome/generation)と報告されている(Drake (1993) PNAS 90、4171-4175.)。もし鋳型となるRNAゲノムが正しい塩基配列であったとしても、このファージゲノムからたった1回のコピー(複製反応)でつくられたRNA中にはすでに平均6.5個の塩基置換が起きていることを意味する。しかし、ファージは野生型形質を失うことなく植え継がれる。ファージの増幅には、大腸菌への吸着(F繊毛上の受容体認識)、 RNAゲノムの注入、ゲノムRNAをmRNAとした大腸菌内での複製酵素翻訳、RNAゲノムの増幅、ファージ粒子構成タンパク質による複製酵素翻訳過程の阻害、溶菌タンパク質(A2)の発現、大腸菌内でファージ粒子の再構築、大腸菌の溶菌を伴う放出、という多段階かつ一連の流れがあり、どの過程が失敗してもファージ粒子の増幅は達成されない。この複雑な調節系を大腸菌内という変化し続ける(そして相互作用・生体防御を発動する)環境で自身の増幅を制御できたQβファージのRNAゲノムのみが、ファージ粒子に包まれ植え継がれるため、上記の「遺伝子発現調節」が淘汰圧となって「野生型」表現型を有する遺伝子型群が生き残るであろう。
大腸菌を「宿主」としたRNAウイルスであるQβファージは、セントラルドグマに含まれない反応である RNAの複製過程によってそのゲノムを増幅する。一般にRNA複製反応には校正機構が無く、高い変異導入率を有するため、ファージゲノムの複製段階では高いerror rateにより自身の増幅が邪魔される筈である。実際、Qβファージのゲノムは4200塩基ほどの一本鎖RNAだが、報告されている突然変異率は6.5(/genome/generation)と報告されている(Drake (1993) PNAS 90、4171-4175.)。もし鋳型となるRNAゲノムが正しい塩基配列であったとしても、このファージゲノムからたった1回のコピー(複製反応)でつくられたRNA中にはすでに平均6.5個の塩基置換が起きていることを意味する。しかし、ファージは野生型形質を失うことなく植え継がれる。ファージの増幅には、大腸菌への吸着(F繊毛上の受容体認識)、 RNAゲノムの注入、ゲノムRNAをmRNAとした大腸菌内での複製酵素翻訳、RNAゲノムの増幅、ファージ粒子構成タンパク質による複製酵素翻訳過程の阻害、溶菌タンパク質(A2)の発現、大腸菌内でファージ粒子の再構築、大腸菌の溶菌を伴う放出、という多段階かつ一連の流れがあり、どの過程が失敗してもファージ粒子の増幅は達成されない。この複雑な調節系を大腸菌内という変化し続ける(そして相互作用・生体防御を発動する)環境で自身の増幅を制御できたQβファージのRNAゲノムのみが、ファージ粒子に包まれ植え継がれるため、上記の「遺伝子発現調節」が淘汰圧となって「野生型」表現型を有する遺伝子型群が生き残るであろう。
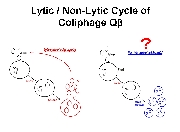
一方、F+もしくはHfr形質の大腸菌の対数増殖期にQβファージを感染させた後にこれを希釈し培養すると、大腸菌とファージ粒子の双方が共存して増殖する様子が確認され、この共培養は抗Qβファージ血清存在下でも成立することが1980年頃渡辺格らによって報告されている (Watanabe I et al. (1979) Microbiol. Immunol. 23, 1077-1083)。これは、感染菌を溶かして子孫を外界に放出させるQβファージの感染サイクルとは全く異なる増殖戦略であり、Qβファージの「擬似溶原化状態」を報告したものである。in situ hybridizationの結果、タンパク質翻訳までの過程が進行した状態でとどまった感染状態であることが示唆されており、何らかの理由でファージタンパク質の発現・翻訳・蓄積が停止した状態で保持されたものではないか、と考えられている。野生型ファージ用の植え継ぎにより得られるファージゲノム(溶菌活性など毒性の高い形質)と大腸菌内に留まりやすいファージゲノム(毒性の低い形質)を得た場合、そこには如何なる適応変異の差が読み取られるであろうか?
2.新規ウィルス研究法の開発/ Improvement of procedures for virus research
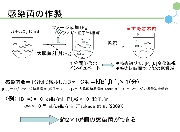
 ウイルスやファージを理解するだけでなく、その利用法をも考える場合、具体的かつ定量的に増殖戦略を解明することが必要である。われわれは定量的に説得力の高い研究手法を適宜提案し、ファージと大腸菌の感染ダイナミクスに関する研究を進める。そのために、大腸菌の数を測定する方法として便利なコロニー計数法や、ファージの数を測定する方法としてよく用いられてきたプラークアッセイ法も検討対象とし、これらが不適当な場合には他の計数法を用いている。また、1950年代からのファージ研究の歴史の中で提案されてきた他の手法に関しても、定量性の観点から再検証し、適切な工夫を随時盛り込むことによって新たな研究手法として提案していく。
ウイルスやファージを理解するだけでなく、その利用法をも考える場合、具体的かつ定量的に増殖戦略を解明することが必要である。われわれは定量的に説得力の高い研究手法を適宜提案し、ファージと大腸菌の感染ダイナミクスに関する研究を進める。そのために、大腸菌の数を測定する方法として便利なコロニー計数法や、ファージの数を測定する方法としてよく用いられてきたプラークアッセイ法も検討対象とし、これらが不適当な場合には他の計数法を用いている。また、1950年代からのファージ研究の歴史の中で提案されてきた他の手法に関しても、定量性の観点から再検証し、適切な工夫を随時盛り込むことによって新たな研究手法として提案していく。
3.モデル生命システムの共進化/ Experimental model analysis for understanding co-evolution mechanisms of life
生物は多かれ少なかれ他の存在物(生物・無生物問わず)と相互作用しながら、生存してきた。ある報告によると、地球上には1000000000000000000000000000000(0が30個)のバクテリアとそれとほぼ同数のファージが生息している惑星であるらしい。実験室において、バクテリアとファージの共存培養を行い、そのダイナミクスを両者の軍拡競争として追跡することで、生物間の相互作用を定量的に観察できる。特にバクテリアとファージの共存培養軍拡競争的な共進化のダイナミクスが観察できるであろう。バクテリアがひとたび過度にファージ耐性を獲得すると、ファージは感染や増殖ができなくなってしまう。一方ファージも適度に感染力を低く保たないと、大腸菌を全滅させてしまい、結果としてファージは感染や増殖ができなくなってしまう。バクテリアとファージの共存培養軍拡競争的な共進化はどのようなシナリオで進行する性質があるのだろうか。

 ホーム
ホーム ファージ研究
ファージ研究 論文・学会発表
論文・学会発表 ギャラリー
ギャラリー