環境と分子システム →for details see here
研究のねらい
レゴブロックをたくさん組み合わせると色々な形のものを作ることができます。生物の構成部品でも同じようなことができるようになってきました。 我々は、約100種類の分子を人工的に組み合わせて作り上げた「人工細胞」を用いて新しい膜タンパク質、酵素、機能性ペプチドの創出を目指して研究を行っています。 また、このような「ものづくり」を通して生命システムの動作原理の解明にも取り組んでいます。具体的には、 脂質2重膜小胞リポソーム内で再構成型無細胞翻訳系PURE systemを用いてタンパク質を合成できる分子システムを用いて以下の3つの研究・開発を行っています。
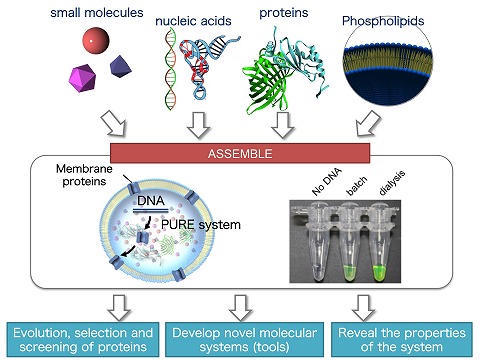
▲図1:ボトムアップアプローチのよるものづくり |
膜タンパク質は、ゲノム上の全タンパク質の20-30%、創薬のターゲット分子の50%を占めています。 さらには、細胞が外部環境を感知するのにも重要な役割を果たしています。このような重要性にも関わらず、進化分子工学的手法は、 膜タンパク質にほとんど適用されてきませんでした。高度に精製した分子だけを用いて組み上げた分子システムを使った「ものづくり」を目指しています。 最近、我々は膜タンパク質をin vitroでエンジニアリングする技術(分子システム)Liposome displayを再構成型無細胞翻訳系PURE systemと細胞サイズの リポソームを用いて構築することに成功しました[Fujii et al., PNAS, 2013](図2)。この分子システムを用いて新しい膜タンパク質の創生に取り組んでいます。 これにより、バイオセンサー開発、創薬の促進、さらには新しい産業分野の創生が期待されます。
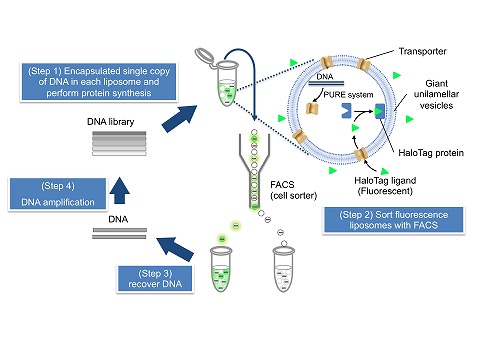
▲図2:Liposome display(リポソームディスプレイ)法の概略図 |
Liposome display法に用いる実験系は、高度に精製された分子のみを再構成した分子システムです。 よって、全ての成分の濃度や種類を自在に変更することが可能であり、ゆえに、従来法では不可能だったタンパク質のエンジニアリングが可能となります。 例えば、トランスロコンの導入、脂質組成の改変などにより真核生物由来の膜タンパク質のエンジニアリングも可能となることが期待されます。 また、現在はセルソーターを使っていますが、このような高額機器を必要としない、汎用性の高い手法の開発にも取り組んでいます。
3. 生命システムの普遍的な法則性の解明部品から組み立ててみてはじめてわかることがあります。 我々は、再構成型無細胞翻訳系PURE systemを用いてリポソーム内で膜タンパク質を合成する実験系を使っています。 生細胞にも同様の反応があるので、これは擬似細胞と呼ぶことができます。ただ擬似細胞と生細胞の違いは、前者は特定の性質を発現するのに最低限必要な 成分のみから構成されていることです。最小限の構成要素しかもたない分子システムが示すダイナミクスは、現在の細胞を眺めただけでは複雑すぎてわからない。 よって、ボトムアップアプローチにより、生命システムを再構成し、そのシステムが示す普遍的な法則性を明らかにすることは生物の動作原理を理解する上で重要です [Soga et al., ACS Synth Biol, 2013](図3)。特に、我々は、リポソーム内膜タンパク質合成系を用いて、法則性を探究しております。 また、見出された法則性がより高次の生物システム、例えばミジンコの生活環でも表れるのかを探っています。
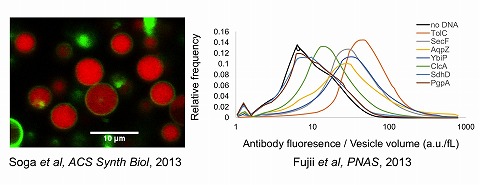
▲膜タンパク質をディスプレイしたリポソーム。大きさと膜挿入効率の関係性を明らかにした。 [Soga et al., ACS Synth Biol, 2013] |
どのような分野の研究か?
In vitro合成生物学、進化分子工学、構成生物学という分野の研究です。ボトムアップに分子システムを使っています。
実験材料は?
高度に精製されたタンパク質、核酸、低分子化合物を混合することで作られる再構成型無細胞翻訳系PURE systemを主な材料として使っています。 これに加えて、リン脂質、抗体、種々の蛍光物質などを使っています。 蛍光顕微鏡、フローサイトメーターを主に使用しますが、遺伝子操作全般、タンパク質関連操作全般も必要です。

